金属内部をのぞく
元素と原子
「あらゆる物質は原子からできている」ということは学校でも習うし、なんとなくではあっても誰もが知っていることと思います。自然界には概ね90種類くらいの元素があり、物質はこれらの組合せでできているワケです。このサイトで対象としている鉄鋼などの金属材料も、突詰めていけばいくつかの元素が組合わさったものです。
ここで「元素」と「原子」との違いをハッキリさせておきましょう。例えば水は水素と酸素の化合物で、化学式ではH2Oと書きます。水という物質は水素と酸素からできており、ここでの水素や酸素は水を構成する「元素」です。元素としての純粋な水素、純粋な酸素は、常温では気体として存在するので、水を電気分解すると水素ガスと酸素ガスとに分かれます。そして化学式から解る通り、容積比は水素:酸素=2:1です。
水素ガスや酸素ガス、そして水を限りなく拡大して見ると (実際には見えませんが間接的に観察することはできる)、それぞれが粒子状の‘ツブ’で構成されています。水素ガスは水素の元となるツブが2つ組合わさっており、このツブを「原子」と呼びます。水素は水素原子2個が結合して水素分子を構成しているというコトになります。酸素分子も酸素原子2個で作られ、水分子は水素原子2個と酸素原子1個から成っています。
元素は金属だらけ
簡単な周期律表を示しておきます。この表で色付きの元素は金属です (ブラウザによっては識別できないかもしれませんが)。周期律表を見渡すと、実は元素って金属だらけなんです。
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | H | He | ||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| 6 | Cs | Ba | *1 | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | *2 | Rf | Db | Sg | Bh | Hs | Mt | |||||||||
| *1 | lanthanoid | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | ||
| *2 | actinoid | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | ||
17族のハロゲン元素と18族の希ガス元素は総て非金属ですが、それ以外では周期が重なるにつれて非金属が減っていくような状態で、「有機化学でよくお目見えする元素以外は金属」という印象です。半導体素材となるのは金属と非金属の境目なんでしょうかね。表で黄色っぽくしてあるのは人工元素で、原子炉や加速器でしか見られず自然界にはほとんど存在しません。
原子の構造
原子はこれ以上分解できず、物質を構成する究極の‘ツブツブ’です。つまりこの世に存在する物質は原子の種類によって限定されます。しかし量子力学の分野では原子を更に細かく観察し、原子核の周りを電子が回っているモデルが提唱されます。原子核は更に陽子と中性子とから成り、この原子核の崩壊 (大きな原子核が分解する) 時に発生するエネルギーを利用したのが原子力発電です。もっと細かくクォークだとかレプトンだとかに細分化する素粒子学もありますが、ここではそこまでハナシを進めません。
原子にはマイナスの電荷を持つ電子と、プラスの電荷を持つ陽子とが同数あり、電気的には中性です。陽子は中性子 (電気的には中性) と共に原子核を構成し、電子がその周りを回っているイメージです。ちなみに、原子核の周りを電子が取巻くモデルを提唱したのは長岡半太郎博士であり、同極で反発し合うはずの陽子が中性子と一緒に核子を成す理由として中間子論を掲げたのは湯川秀樹博士です。日本って原子物理学に結構関係の深い国なんですね。
さて、原子の持つ電子 (または陽子) の数を原子数と言い、自然界には原子数1の水素から、原子数92のウランまでが存在します。しかし何らかの理由により通常より電子が多くなってマイナスに帯電したり、電子が少なくてプラスになった原子もあり、これらをイオンと呼びます。食塩を水に溶かすとNa+ (ナトリウムイオン) とCl- (塩素イオン) に分かれます。気体の状態でイオン化したものをプラズマと呼び、プラズマは熱処理分野でも応用されています。
元素の性質を決める要因
元素としての性質は、原子が持つ電子の数に大きく影響されます。例えば水素の場合、陽子1個と電子1個とで構成されるのですが、水素原子の電子軌道には電子が2個まで入れることになっています(s軌道と言う)。でも陽子との電気的なバランスのため、電子を2個持つことはできません。このように限定的な軌道に限定した個数の電子が配置されるというルールのことを排他律と言います。電気的なバランスは取れているけど排他律からすると席が1つ余っている状態です。そこで同じ水素原子2つで、2個の電子を持ち合って空席を埋めようとするため、水素分子は水素原子2個で作られることになります(共有結合)。これが原子数2のヘリウムになると、s軌道が満たされ、単独でいる状態が最も安定となります。反応性が低く化合物も作りません。更に原子数が増えて3のリチウムになると、s軌道は満たされており、排他律によってこれ以上の電子を配置できないので、次の軌道に配置されるコトになります。s軌道のある位置はK殻と呼ばれ、その外側にあるL殻には2s、2px、2py、2pzの4つの軌道があって、それぞれに電子が2つ配置できるのですが、K殻に空席がないのですから3つめの電子はL殻に追出されます。内側の軌道にある2つの電子は化学反応等に関係せず、常に一番外側の軌道にある電子が反応性を左右するので、これを最外殻電子と呼んで特別に扱います。さて、2番目の軌道群であるL殻は電子8個まで配置できるので原子数10のネオンになると満席になり、ヘリウムと同様に反応性が低くなります。このように見ていくと周期律表の一番右側に並んでいる元素は「満席 (完全充填)」の不活性元素であることが解ります。
物質はできるだけエネルギーの少ない状態に落着こうとします (熱力学の第二法則ですね)。高い場所にあるものは位置エネルギーを減らして落下したがるし、電気エネルギーを溜め込んでいれば外部に電流を流そうとします。振動しているものは放っておけば減衰し、熱エネルギーで熱くなっていれば冷めていきます。電子軌道が満席でないとエネルギー的には高い状態であるため、最外殻電子が中途半端な数の原子はどうにかして軌道を満たそうとします。先述のイオンの場合、電気的には中性でいることが、排他律的には最外殻を埋める (または空ける) ことが、エネルギー低位となるのですが、両方は満たせないので折衷案のような状態で取り合えず落着いているものと理解できます。
金属結合
原子が結合する方法を分類すると、1)共有結合、2)イオン結合、3)金属結合、4)ファンデルワールス力による結合、の4つがあります。
共有結合は原子が電子を共有する結合で、先述の水素分子や酸素分子、水分子の例も共有結合です。強固な結合方法であり、炭素原子が共有結合で結晶化したものがダイアモンドです。
次にイオン結合ですが、先程の食塩のように陽イオンと陰イオンとに分かれたものが固体化する際、電気的なプラスとマイナスとが引合う形で結合したものです。異極結合とも言い、これに対して共有結合は同極結合と呼ばれます。
原子が特定の電子を捕らえるように結合するのではなく、「多くの原子で多くの電子を持ち合う」ように結び付くのが金属結合です。電子は複数の原子に所属することで割と自由に行き来できる状態になっていて、これを自由電子と呼びます。この自由電子の働きにより金属は電気や熱を伝えやすく、電子雲によって光が反射されて独特の金属光沢を呈します。また部分的に結合が外れてもすぐ隣の原子と再結合でき、これによって大きな塑性変形能を有します。
ファンデルワールス力とは聞き慣れませんが、ごく弱い力による結合と理解して下さい。電気的には中性の原子であっても、近くにある別の原子による相互作用で電荷の中心がずれたり、分子内でのポジションによって電子の位置がそれとなく限定化されたりして一時的に分極し、電気的な引力が生じて他と結合するものです。モース硬さ最高値を示すダイアモンドの同素体である石墨 (黒鉛) は、ファンデルワールス力により層状結合してる部分が劈開しやすく、モース硬さでは最低ランクです。どちらも同じ炭素なのに面白いですね。
これまでは原子核の周りを電子が回っているイメージで原子を捉えてきましたが、極微の世界ではこれまでのように粒子としての存在というより、確率的な存在として捉えられることがあります。例えば電子は‘粒’として軌道を回っているパターンと、「なんとなくこの辺りにモヤっとある」といったイメージの両方が量子力学では唱えられています。不確定性原理といって、粒子として位置を確定させると運動量が不定になり、運動量を確定させると位置があやふやになるという、なんだか心許ない感じの法則によって、軌道上のツブとしての電子ではなく、存在確率の大小によるモヤモヤした雲のような捉え方をして、電子をこのように扱う場合は‘電子雲’と呼んだりもします。ここから先では量子論的なこれらの原子モデルではなく、もっと簡略化して原子を球体と見なします。原子数が小さな原子は球の直径も小さく、原子数の大きな原子は大きな直径であると考えて下さい。
金属の結晶構造
単結晶と多結晶
金属は結晶を作って固体化します。結晶とは長周期の規則性を持った固体で、原子が規則正しい配列で並び、その配列の仕方によって結晶の性質が変ってきます。代表的な結晶としてダイアモンドや水晶など、宝石と呼ばれる鉱物では結晶構造がそのまま外観に現れるものもあり、これらは単結晶と呼ばれます。ファンタジーアニメの「海賊のお宝」的なシーンなどでよくお目見えする水晶は六角柱の形で描かれていますが、結晶構造もそのままで、結晶の成長が固体としてのサイズに等しくなります。つまり水晶ひと塊が1つの結晶で成り立っています。
これに対して金属は多結晶体であり、多くの結晶がひしめき合った組織です。規則性を保った範囲を結晶粒と言いますが、結晶粒が成長していった先に他の結晶があればそこで成長は阻害され、境界部分は結晶粒界と呼ばれます。ひとつの結晶粒が大きかったり小さかったりで性質が変化し、結晶粒が大きいほど塑性変形が容易で、逆に結晶粒が小さいほど硬くなります。つまり結晶粒が大きな状態で加工して、加工後に結晶粒を小さくできれば、小さな力で塑性加工ができる上、その後硬くすることができます。
多結晶体である金属の場合、一般には結晶粒が細かいほど機械的性質は良好です。金属部品は外力による変形が少ないことを求められる場合が多く、よって高強度な材料が好まれます。
代表的な結晶格子
結晶は原子が格子状に並んでおり、原子を球体として見ると球が規則正しく配列したモデルとなるため、これを結晶格子と呼びます。結晶格子はどこまでも同じ並び方をしているので、その対称性を立体的に捉えて最も基本となる配列を取出したものを単位格子と言います。単位格子が三次元的に並んだモノが結晶というワケです。
金属の結晶は以下の3つの構造をしているものが多く、世の中にはこの3つを説明している解説書が殆どです。

立方体の頂点と重心部分に原子が配置したものを体心立方格子と呼びます。頂点にある原子は隣の単位格子の体心も兼ねており、同様に体心部の原子は前後左右上下に隣接する8個の単位格子の頂点を兼ねています。比較的変形しにくい構造で、鉄の結晶構造は常温で体心立方格子です。図を見ると9つの原子でひとつの単位格子を成しているように見えますが、各頂点は前後上下左右に続く格子の一部でもあり、所属割合は1/8となります。頂点8箇所に同じような原子が配置し、体心部の1と合わせて単位格子に属する原子は2つとなります。
体心立方格子の幾何学的特徴について考えてみましょう。温度が上がるにつれて熱振動の振幅は大きくなり、各原子間の距離は変化しますが、ここでは各原子は隣接しているものとしてハナシを進めます (絶対温度ゼロの状態と考えて下さい)。立方体の辺を構成する原子間距離をa、格子を構成する金属元素の原子半径をrとすると、格子の角部と体心、更にその先にある対角部は隣接して一直線に並んでいますので、4r=√3a、よってr=√3a/4となります。原子球の体積は(4/3)πr3ですから、所属原子数が2であることから単位格子内の原子球体積は2(4/3)πr3、rを代入して2(4/3)π(√3a/4)3となり、これを整理すると(√3/8)πa3となります。一方、格子の占有容積はa3なので、格子密度は(√3/8)πより、約68%となります。
体心立方格子の結晶構造を持つ金属としてはクロム (Cr)、モリブデン (Mo)、タングステン (W) などがあり、比較的変形しにくい金属となっています。鉄 (Fe) も低温では体心立方格子を成します。

立方体の頂点と6つの面の中心に原子が配置したものを面心立方格子と呼びます。ボールを積み重ねてみれば解りますが、原子が最も密に詰まった構造です。その一方で滑り面 (原子が同一平面状に並ぶように見える面) が多く存在し、塑性変形が容易な構造をしています。鉄を高温に加熱すると面心立方格子に結晶配列が変化します。頂点8箇所の原子は所属割合が1/8、面心部は1/2の割合で6箇所あるので、格子に所属する原子数は4つです。
面心立方格子の格子密度を体心立方格子の場合と同様に求めてみましょう。立方体の辺を構成する原子間距離をb、格子を構成する金属元素の原子半径をrとします。面心立方格子では各面の対角線上に原子が隣接して並んでいますので、4r=√2b、よってr=√2b/4となります。原子球の体積は所属原子数が4なので、4(4/3)πr3、rを代入して4(4/3)π(√2b/4)3となり、これを整理すると(√2/6)πb3となります。単位格子の占有容積はb3なので、格子密度は(√2/6)πより、約74%となります。
体心立方格子と面心立方格子とでは、面心立方格子のほうが密に詰まっていることが解ります。面心立方格子は原子が最も密に詰まった結晶構造のひとつで、その分比重が大きくなります。面心立方格子の結晶構造を持つ金属としては高温の鉄 (γ-Fe) 以外にもアルミニウム (Al)、ニッケル (Ni)、銅 (Cu)、銀 (Ag)、金 (Au) などがあります。

原子を六角形に並べ、その上に三角形、更にその上に六角形を重ねた、全体としては六角柱のような形の格子を稠密六方格子と言います。面心立方格子と同様に原子が最も密に詰まった構造ですが、滑り面が少ないので加工性は劣ります。
実は面心立方格子の単位格子の頂点を手前にして眺めてみると稠密六方格子と非常に良く似た並びをしています。六角を基本にした並びの上で凹んだ部分に玉を並べるとこれも六角並びになります。更にその上の層を並べる際に一段目の玉の真上に配置されるような並びにすれば稠密六方格子、ずれた位置で並べれば面心立方格子となります。三層目の位置関係が違うだけなので、格子密度は面心立方格子と同じく約74%です。マグネシウム (Mg) やチタン (Ti)、コバルト (Co) などがこのような結晶構造をしています。
それでは実際に稠密六方格子の密度を計算してみましょう。この結晶格子は六角形の一片を成す二つの原子と六角形の中央にある原子が正三角形に並び、その中央の窪みにもう一つ原子が乗っかった構造が基本になっていることが解ります。つまり牛乳のテトラパックのような正四面体が見えてきます。六角形の一辺を構成する原子間距離をcとすると、この正四面体の一辺は同じくcということになります。ここから正四面体の高さを計算すると√(c²-(c/√3)²)=√(2/3)cとなり、この2倍が六角柱の高さとなるので、六角形の面積に乗じて(√3/4)c²*6*√(2/3)2c=3√2c3となります。所属する原子数は1/6*12+1/2*2+3=6なので原子球体積は6(4/3)πr3=8πr3です。ところで、r=c/2なので原子球体積は更にπc3と計算されます。格子密度はπc3/(3√2c3)=(√2/6)πで、面心立方格子と同じく約74%となります。
他にも様々な結晶構造がありますが、今のところこのくらいで充分です。それどころか鋼の熱処理を理解する上では体心立方格子と面心立方格子の2つを押さえておけばOKです。Fe結晶は低温で体心立方格子であるα鉄、高温では面心立方格子のγ鉄となり、鉄と炭素との合金である鋼においてはそれぞれをフェライト、オーステナイトと呼びます。オーステナイトはフェライトよりも原子が密に詰まっているのは上記で計算した通りですが、原子間の最大隙間は実はオーステナイトのほうが大きくなります。詳しい計算は省きますが、体心立方格子の最大隙間に入る球体の半径が単位格子の1辺に対して13%程度、面心立方格子の場合は15%程度となり、面心立方格子のほうが単位格子サイズが大きいので、体心立方格子に対して4割ほど大きな隙間となります。Feの原子半径を125pm、Cの原子半径を77pmとすると、フェライトの隙間に入る球体半径は約36pm、オーステナイトでは約52pmとなり、オーステナイトのほうが炭素を固溶しやすい理由が解ります。
ところどころに格子欠陥
ここまでは結晶の‘規則正しさ’を強調してきましたが、実は金属の結晶は規則性が乱れる部分が結構あります。規則的でなくなる部分を格子欠陥と呼び、いくつかの種類に分類されます。
本来あるべき場所に原子が配置されていないものを原子空孔 (単に空孔とも) または空格子、逆に原子が余分に割り込む形で配置されたものを格子間原子と言い、これらをまとめて点状欠陥と呼びます。
点状欠陥が一次元的に連続したものは線状欠陥となります。代表的な線状欠陥に転位があり、これは塑性変形や材料強化機構にとって重要な働きがあるので、詳しくは次節に譲ります。
規則性の乱れが二次元的に広がったものは面状欠陥と言い、積重なり方が少しだけずれて規則性を失った部分を積層欠陥と呼びます。また結晶粒界も面状欠陥の代表例です。
転位による塑性変形

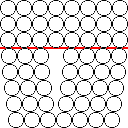
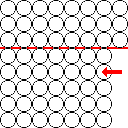
格子欠陥がない結晶の場合は原子が規則正しく配列しますが、金属の結晶は多くの欠陥を含んでいます。その中でも代表的な線状欠陥のひとつである転位は、金属の塑性変形を語る上で非常に重要な要素です。右に転位の一種である刃状転位の概念図を示しますが、このような配置が画面に対して垂直方向に重なっている (原子が欠落している部分が線状になる) と解釈して下さい。規則配列に対して原子配列面が1枚余分に差し込まれたような状態を「刃」で切り込んだ様子に見立てて「刃状」と表しています。「刃」にこじ開けられて隙間になっている部分が転位線です。
塑性変形は金属結合がずれることで実現しますが、欠陥のない組織においては多くの原子が外力に対抗してなかなか変形しません。しかし多数の転位を含む結晶では転位が移動することによって結合の組換えが容易に起こり、結果として理論値よりも遥かに少ない力で変形させることができます。右図では転位の移動面 (滑り面と言う) を赤線で示してありますが、ここに剪断方向の力が加わると転位が力の向きと反対に移動し、ずれた位置での原子の再結合が伝播していく様子が想像できます。一度に「よっこらしょ」は難しいけど、順番にリレーしていけば簡単にずらせるワケですね。
図では変形の結果、転位が消失したように見えますが、実際には更に先に進んで、邪魔さえなければ結晶粒界にまで達します。しかし結晶中には多くの転位が、しかも三次元的に入組んで存在し、向きの違う他の転位に移動を阻まれたりもします。また右図では転位線と全く平行に外力が加わっているようにモデル化していますが、そもそもこのようなケースは皆無と言ってもいいでしょう。ここではある結晶の一部分のみを抜出していますが、外力により金属を構成する数多くの結晶の色々な場所で転位の移動が同時多発的に起っています。そして塑性変形が進むにつれて多くの転位が絡み合い、移動が困難になっていきます。つまり硬くなっていくワケで、このような現象を加工硬化と言います。塑性変形が大きいほど転位がもつれ、結晶粒は変形し、内部にストレスを溜めながら硬さが増していき、限界を超えてしまうと破断します。これは針金を繰返し曲げていると徐々に硬くなり、その内にポロッと折れてしまう現象で実感できます。
ここでは刃状転位に剪断力が働いた場合を解説していますが、螺旋転位と言って、転位線を中心に360度ぐるっと一周すると1段ずれた原子面と結合している、螺旋階段のような形態の転位もあります。いずれにせよ金属結晶には無数の転位線が存在し、転位の移動が塑性変形を担う役割を果しながら、一方でこれらが高密度に絡み合うほど変形しにくくなるという図式を理解して下さい。
他元素の混ざり方
100%純金属というモノは、恐らく入手不可能でしょう。金属から不純物を取除くのは非常に難しく、金の延棒にも‘99.99%’などと刻印されていて、つまりは0.01%程度の不純物は混ざっているということになります。
鉄鋼材料の場合、純鉄を (特に工業用途において) 使う場面というのは非常に稀な例なのではないでしょうか。通常は「鋼」、つまり鉄と炭素の混ざったモノを使用し、このように複数の元素が混ざった金属を合金と呼びます。鋼材の場合、溶解時に加えられたコークスに由来する炭素、精錬時に脱酸剤として添加される珪素やマンガン、また鋼の性質を悪くするため無くしたいケド取除くことが困難なリンと硫黄、この5つを「5元素」と呼び、総ての鋼にはこれらが含まれていると言っていいでしょう。またほとんどの鋼でこれら5元素の重量パーセントを規制しており、成分表として記載しています。鉄に合金元素が加えられ鋼として製造される際、結晶中で添加元素がどのように存在するのかで、その元素が鋼の性能に及す影響が違ってきます。
ここでモノの「混ざり方」について、少し整理しておきましょう。
水に食塩が混ざって塩水となる場合、食塩は水の中で塩素イオンとナトリウムイオンに形を変えて混ざっていますが、温度が上がって水が蒸発すれば再び結晶化し食塩に戻ります。逆に冷やされていくと、水は凍りますが食塩は氷の結晶から追出されていき、次第に濃縮されていきます。一般に混ざりモノがある水は凝固点 (融点) が低温側に移動し、氷点より遅れて固体化しますが、溶ける場合はその反対で混ざりモノから液化します。部活のためにスポーツ飲料を凍らせて持って行き、最初の休憩時間に半分位溶けた状態で飲むととても濃いのですが、後半の休憩時間には水っぽくなり飲み応えがなくなってしまうのも、混ざりモノの濃度によって融点が違ってくるためです。
これに対して、固体となっても溶け合ったままで安定する場合を固溶と言い、固溶した固体を固溶体と呼びます。鋼の最も代表的な合金元素である炭素の場合、侵入形固溶と言って格子間に割込むように溶け込み、固溶限である0.02%までなら鉄の結晶中に完全に固溶して、炭素だけで別の結晶を形成するようなことはありません。ただし固溶限を超えた炭素は、鉄と化合物を作ったり、黒鉛として現れたりします。さて、炭素は原子半径が小さいため侵入形で固溶しますが、例えばクロムのように鉄と原子半径が似た元素の場合、鉄原子に置き換わって固溶し、このような混ざり方を置換形固溶と呼びます。固溶のしかたが侵入形であっても置換形であっても、鉄結晶の規則性を阻害するものであることには変わりなく、固溶によって結晶の性質は大きく影響されます。
結晶の配列変換
同素変態
構成元素は同じでも原子配列が異なることでまったく性質が違った物質となるとき、これらを同素体と呼びます。酸素とオゾンの関係や、ダイヤモンドと黒鉛も同素体です。物質がある条件化で同素体に変わることを同素変態 (単に‘変態’と呼ばれる場合が多い) と言い、同素変態する条件を変態点と言います。
純粋な鉄は常温でα鉄と呼ばれ体心立方格子を呈しますが、温度を上げていくと911℃で格子配列が面心立方格子となり、これをγ鉄と呼びます。α鉄とγ鉄とは同素体であり、このときの変態点は大気圧下において911℃ということになります。変態は結晶内で瞬間的に起こりますが、鉄は多結晶体なので結晶粒界にエネルギーギャップがあり、総ての結晶が同時に変態するワケではありません。表面の結晶粒は早く変態し、芯部の結晶粒は温度上昇も遅いのでかなり遅れて変態します。変態の時間差は加熱、冷却のいずれでも起こるのでヒステリシスを生じ、加熱速度や冷却速度が速いほどヒステリシスは広がっていきます。
熱処理では鉄の同素変態と温度変化の速度 (特に冷却速度) によって変態点がずれることを利用します。つまり変態点の把握が熱処理にとって重要で、テキトーに熱してテキトーに冷ませばいいというものではありません。キチンとした根拠に基いて加熱·冷却しているワケで、その根拠としてここで解説しているコトが関ってくることになります。
鋼の平衡状態図
純粋な鉄では911℃に変態点があるということは述べましたが、工業用途では鋼、すなわち鉄と炭素との合金というカタチで利用され、炭素の混ざっている量によって変態点がずれていきます。そこで熱処理温度を決める根拠として、Fe-C系複平衡状態図を参考にします。「平衡」とは釣合いが取れて静止していることを示し、加熱途中の過渡的な状態などを排除し、エネルギーの出入りがなくなったときの鋼の様子を図示したものです。熱エネルギー変化については‘非常にゆっくり加熱し、非常にゆっくり冷却する’時の状態を示していると考えて下さい。
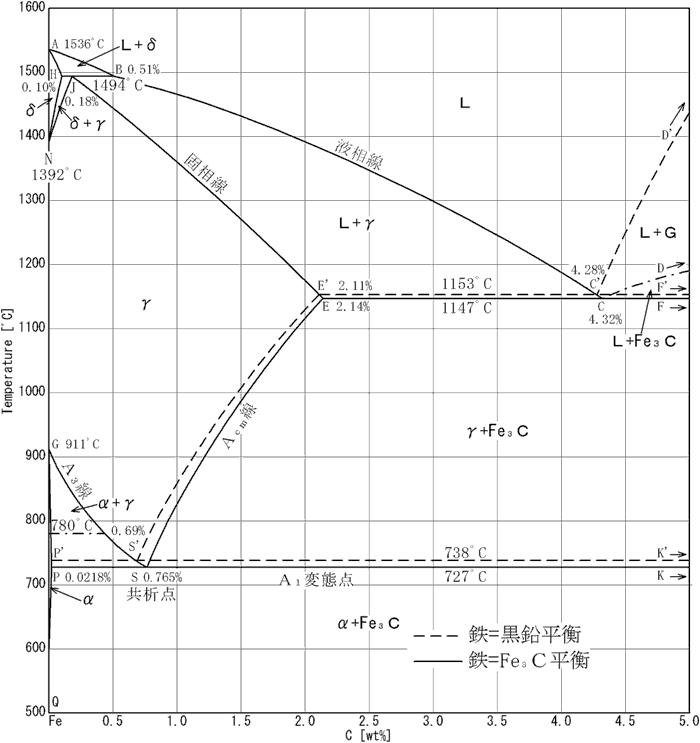
鋼中では炭素がセメンタイト (θ相) と呼ばれる炭化物 (Fe3C) として析出するので、この場合の状態図を実線で示していますが、炭素の最も安定な形態は黒鉛であり、黒鉛と鉄との状態図は点線で示しています。前者を準安定系状態図、後者を安定系状態図と呼び、上図は両者を重ねて示しているため複平衡状態図と呼びます。事実、炭素鋼を高温で長時間加熱すると炭素は黒鉛となって鉄と分離するのですが、一般的な使用範囲では起こり得ない状況であり、熱処理作業や実際の使用状態においては実線の準安定形のみを考えれば問題ありません。鋳鉄のように黒鉛が晶出、あるいは析出する場合や、ボイラー用鋼のように高温で長時間使用される鋼の場合は安定系を視野に入れる必要があります。
各交点の炭素量や直線部分の温度については、文献ごとに細かな数字に違いがあったりしますが、測定精度や作図された年代などの要因による差であり、それほど気にする必要はありません。
それでは図の見方について少々説明していきます。まず図の一番左側、炭素量0% (純鉄) のラインを縦に追ってみます。矢印でαと指している縦長の領域は温度が下がるにつれて0%軸に接しているように見えますが、実際にはほんの少しだけ離れており、Q点は0%ラインよりちょっとだけ右側にあります。つまり純鉄は常温でα単相です。非常にゆっくり加熱していくと911℃(G点) で体心立方格子のα相から面心立方格子のγ相に変態します。更に加熱を進めると1392℃(N点) で体心立方格子のδ相に変態し、1536℃(A点) に達すると液相に変態します。このように液体への状態変化の前に、固体のままで幾つかの相変態が起こり、熱処理ではこの変態を利用して結晶構造を操作しているワケです。
各相には個別の名称も与えられており、鉄のα相 (α鉄) はフェライト、γ相 (γ鉄) はオーステナイトと呼ばれます。δ相 (δ鉄) はα相と同じく体心立方晶であることからδフェライトと呼ばれたりもしますが、熱処理分野ではδ相に変態するような高温を使用しないので忘れてしまって構いません。Fe3Cをセメンタイトと呼ぶことは既にフライングで言ってしまっていますね。
工業分野ではα相のみから成る鉄を「純鉄」として扱いますが、α鉄は炭素を最大でも0.0218%(P点) までしか固溶できません。このときの温度は727℃で、温度が下がって常温になると結晶粒界に多少のセメンタイトが析出します。
炭素量を少し増やして、0.5%のラインをたどってみましょう。実用鋼ではS50Cに相当すると考えて下さい。727℃でセメンタイトは総てオーステナイトに変態しますがフェライトはまだ残っており、α+γ の二相状態になります。770℃付近でA3線を超えるとフェライトもオーステナイトに変態しγ単相となります。加熱を続けると1440℃辺りで固相線を超えて一部液化し、1494℃以上では完全に液相となります。
更に炭素量を増やして、1.0%のラインを見てみます。炭素工具鋼のSK105相当と考えて下さい。727℃でオーステナイトが出始めるのですが、今度はフェライトがオーステナイト化してセメンタイトは残っています。γ+Fe3Cの組成です。820℃辺りでAcm線を越えるとセメンタイトも変態してオーステナイト単相となります。1350℃付近から液相が現れ始め、1470℃程度で完全に液化します。
A-B-C-Dのラインより上の温度では総て液体となり、これを液相線と呼びます。A-H-J-E-C-Fは固相線で、これより下の温度では総て固体となります。液相線と固相線の間では液相と固相が混在します。これらは鋳造で必要となる温度で、熱処理ではここまで温度を上げることはありません。液相線をたどると、炭素量が多いほど下がっており、溶解に要するエネルギーが少なくて済むことが解ります。このため鋳鉄は炭素量を多くしています。
C点は液相から冷やしていった際にオーステナイトとセメンタイトとが同時に晶出するため共晶点と呼ばれます。またS点は共析点と呼ばれ、オーステナイト状態から冷やすとフェライトとセメンタイトとが同時に析出します。共晶点は炭素量、温度共に熱処理の範囲外ですが、共析点は重要なポイントで、熱処理を理解する上では頭に入れておくべき部分です。共析組成 (炭素量0.765%前後) の鋼を共析鋼と言い、共析点より炭素量が少ないものを亜共析鋼、多いものを過共析鋼と言います。
焼入組織として必要なマルテンサイトは急冷によって得られる組織で、平衡状態図には現れません (ゆっくり冷やすのではないので「平衡」ではない)。マルテンサイトはオーステナイト化したものを急冷し、炭素がFe3Cとして析出するヒマを与えず、本来ならフェライトに0.02%しか固溶しないのをムリヤリ押込んだまま体心立方格子に変態させた組織です。炭素を押込まれて格子がややイビツになっているため塑性変形しにくく、硬くすることができます。
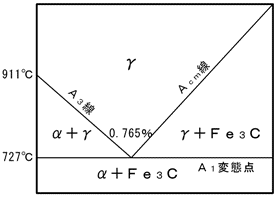
熱処理の対象となる鋼は2%C以下で、また加熱温度もδ相が出現するまで高温にはしないので、炭素量2%まで、温度1200℃までの領域のみを参照すればコト足ります。更に実用鋼としては極低炭素鋼が除外されるので、α単相領域もないものとして考えて差し支えありません。つまり右図のように簡略化された状態図さえ頭に入っていれば、変態に関る熱処理の大部分が理解できます。
例えば機械構造用炭素鋼を焼入れする場合、フェライト相は急冷してもマルテンサイトには変態しません。つまりオーステナイト単相にしなければならないのでA3線より高温に加熱する必要があります。そのため低炭素なものほど高温に加熱する必要があります。一方炭素工具鋼のような過共析鋼では、焼入後もセメンタイトを析出させておきたい上、材料出荷時の球状化処理によるセメンタイトの分布を維持したい場合が多く、セメンタイトをオーステナイトに完全に溶け込ませる必要がないので、炭素量に関らずA1線より上の一定温度で焼入れします。
炭素鋼の熱処理はこの状態図から加熱温度が決まるのですが、機械構造用合金鋼のような低合金鋼もこの図をそのまま思い浮かべて熱処理設計すればOKです。ただし合金工具鋼のような高合金鋼になると、合金元素の影響によってオーステナイト領域が変化します (概ね高温側に狭まる) ので、注意して下さい。